PI3K抑制剂Buparlisib ——BKM120" S1 E! G& P, F# e5 f- N
PI3K抑制剂Buparlisib (BKM120)的说明* K9 l. Y4 J8 A4 R
1.简介0 t' b9 w, J8 G0 r' |7 E! o! j
英文名 NVP-BKM-120,Buparlisib
, F# `" V1 x4 k2 b! t5-[2,6-Di(4-morpholinyl)-4-pyrimidinyl]-4-(trifluoromethyl)-2-pyridinamine
% H+ W4 {4 r! ?6 N' k3 c% y9 w中文名 NVP-BKM-120; 5-[2,6-二(4-吗啉基)-4-嘧啶基]-4-(三氟甲基)-2-吡啶胺) L+ i" v; d( ?+ {* Q& N" }4 v
分子量:410.4
3 j* y! m: [0 p+ U, z" ]+ t研发药厂:诺华制药,Novartis
8 T/ V, j% M( _$ n/ U临床药形态:盐酸盐,分子量:446.9
: X u- g# w4 S8 n# V$ ^0 x% u临床药:游离碱=1.1:19 j) E5 I: f+ v3 O9 U e* V, Y2 Q
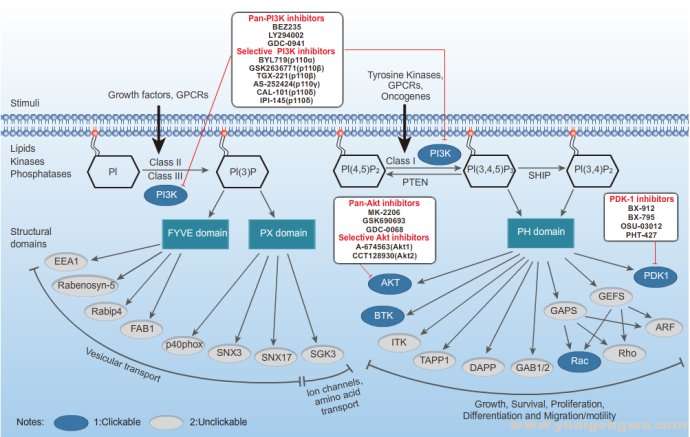
PI3K或者Akt的过度表达并不能导致肿瘤形成,但它们能在其他致癌因素诱导的肿瘤发生过程中起重要的辅助作用。此外,PI3K—Akt途径还参与了肿瘤的发展过程,即通过抑制细胞凋亡,增强细胞对低氧和营养缺乏的耐受能力,辅助肿瘤生长。PI3K是一个复杂的大家族,根据其结构可分为3类:I型、Ⅱ型、Ⅲ型。BKM120是I型PI3K抑制剂。
( n* d& D* V3 Y2 b& d1 R: Y肺癌新靶点以及对应新药:PI3K抑制剂Buparlisib <wbr>——BKM120
* y8 F+ c* p/ |& c
7 J H7 R v m0 B' M3 h/ I" N, yIdentification and characterization of NVP-BKM120, an orally available pan-class I PI3-kinase inhibitor.- C# H, k1 z4 ^2 n
http://www.ncbi.nlm.nih.gov/pubmed/22188813# E) T1 I7 F, n9 \& G
2. 剂量和给药方法
' I7 T3 V& {2 K: s, S6 oBKM120在体内快速吸收,生物利用度为90%,4小时内达到血药峰值,半衰期约为40小时,经过5-8天达到稳态血药浓度,约为第1天的3倍浓度。单药最大耐受剂量(MTD)为100mg每天,联合用药的最大耐受剂量是吉非替尼250mg + BKM120 80mg每天,推荐联合用药的剂量为BKM120 80mg每天(吃5天停2天),可减量至50mg每天。
4 n {+ u) I" [9 x7 w& l$ ?每天一次,空腹服用(至少进食前1小时或后2小时),胃溶胶囊。
9 o1 ]5 i0 Q, E2 E" r肺癌新靶点以及对应新药:PI3K抑制剂Buparlisib <wbr>——BKM120 8 K' G$ H' q6 J M! r
肺癌新靶点以及对应新药:PI3K抑制剂Buparlisib <wbr>——BKM120
* G1 {: |$ C2 }2 C, z9 h肺癌新靶点以及对应新药:PI3K抑制剂Buparlisib <wbr>——BKM120
$ d$ F8 C! }6 K0 Q
# t) @% r; R( Z6 p' X+ z6 x3 副作用和处理方法# P/ O( x. d+ @2 g6 T
BKM120耐受性良好,长期给药引起的副作用为:皮疹,高血糖,腹泻,无食欲,情绪改变,恶心,乏力,瘙痒,黏膜炎和焦虑。
/ l4 a) S5 j1 N100mg/d组:皮疹(1-2级59%,3-4级12%),高血糖(1-2级47%),腹泻(1-2级65%,),无食欲(1-2级47%),情绪改变(1-2级18%,3-4级6%),恶心(1-2级24%,),乏力(1-2级29%,),瘙痒(1-2级35%,3-4级12%),黏膜炎(1-2级29%,),焦虑(1-2级24%)。
8 \, P- N q5 g% U1 q# H80mg/d组:皮疹(1-2级17%,3-4级17%),高血糖(1-2级17%,3-4级17%),腹泻(1-2级17%,),无食欲(1-2级33%),情绪改变(1-2级50%,3-4级17%),恶心(1-2级33%,),乏力(1-2级33%,),瘙痒(1-2级17%),黏膜炎(1-2级50%,),焦虑(1-2级17%)。9 y& H8 c6 {0 e9 f: _/ G
50mg/d组:高血糖(1-2级20%),恶心(1-2级20%,),乏力(1-2级20%,)。# i& o* B/ c$ ~/ x0 n, l
(1)高血糖是与PI3K/mTOR/Akt抑制剂直接相关的副作用,可用药物:格华止(盐酸二甲双胍片),起始剂量为0.5克,每日二次。
/ i" }5 {2 X$ E+ Y' F(2)皮疹和瘙痒是与PI3K/mTOR/Akt抑制剂直接相关的副作用,可用药物:外用皮质类固醇药膏和抗组胺药(开瑞坦)。
3 P$ Q1 t ?8 O4 ](3)腹泻。腹泻症状较轻时,可给予蒙脱石散剂(思密达)。中度腹泻时,可用洛哌丁胺(易蒙停),同时对症治疗,用口服补液盐(ORS)预防和纠正脱水、补充电解质,口服维生素。# z2 S, w' D% P' t* ~2 B
1 @! R) I/ k5 m
********************************************************************
6 I6 a3 d- x7 ]+ _' C! W
& a( b9 z! g+ T# X# ~注:易蒙停的使用5 i. `# e8 B- p+ C1 Q
易蒙停4mg,随后2mg/4h,至腹泻停止12h停药;若24h后腹泻未停止,易蒙停增量至2mg/2h,酌情加用口服喹诺酮类抗生素(如氟哌酸);若 48h后腹泻仍未停止,应用奥曲肽,100~150μg SC q8h,用药至腹泻停止24h。不推荐预防性应用易蒙停来预防腹泻。2 c3 r& H" Y9 B- F0 D! u- l6 Q
若腹泻严重,或伴呕吐、消化道出血、少尿、无尿甚至休克时,应禁食,立即静脉滴注大量液体维持水和电解质平衡,静脉滴注多种维生素,有低钾血症时还须补钾。重症患者可考虑短期应用糖皮质激素,以减轻中毒症状。
" E/ w. n( p! \避免食用会加速肠蠕动的食物或饮料,如乳制品、果汁、大量的水果和蔬菜、胡椒、辛辣食物等;推荐藕粉、米粉、稀饭、小米粥、不加油的面汤等流质,热苹果泥。1 v( I6 }7 Q# Q0 M0 k
注意腹部的保暖,可用暖水袋热敷腹部。清洁臀部和肛周,避免感染。
% b* y* F. \. w4 h& r9 K其它推荐药物有:地芬诺酯(Diphenoxylate,苯乙哌啶)、微生态制剂-培菲康(Bifico, 双歧三联活菌胶囊)、丽珠肠乐(口服双歧杆菌活菌制剂)等。7 e2 H2 \$ K7 l6 N# {3 Y
u! z' w* ?' ?7 o4 d(4)情绪改变。BKM120能通过血脑屏障(诺华的数据显示有一名脑转病人的肿瘤缩小了28%),影响中枢神经系统,可能导致情绪改变。情绪改变的程度与BKM120的剂量相关。可用药物:选择性5-羟色胺再摄取抑制剂,百忧解(氟西汀),赛乐特(盐酸帕罗西汀)。6 r4 Y9 q/ U7 k4 R* P- Y- @
(5)黏膜炎。口腔炎:保持口腔清洁,早、晚用软毛刷刷牙,餐后用漱口水;口服VC+VB2,避免进刺激性食物,必要时予复达欣、甲硝唑抗炎治疗。口腔局部可用VC+VB2+蜂蜜涂抹。也可以用溃疡散、康复新等。VC可以用拜耳的力度伸泡腾片。
2 Z: ^" Y* s( b. [/ r9 x$ Y; |( q(6)无食欲以及处理
; U3 [2 d) V2 g* e' E少食多餐,提供高能量、高蛋白质饮食或营养补充品(安素、保康速、速愈素等)。2 E' P- `$ B, ]# V7 q9 ~9 [
四磨汤口服液
, E6 X0 L% v! M2 M, [甲地孕酮(Megestrol acetate):160mg每天,一天一次口服,7-28天。* m2 A, b% b" M6 v8 B+ I# _" v- O
地塞米松(dexamethasone):每天2-4mg,一天分二次口服。5 {; `- Y2 z# v
乳铁蛋白:每天500-2000mg,一天分二次口服。- ~0 k" Q5 r9 a0 a" f$ s! O2 _
(7)恶心。胃复安(metoclopramide)。
$ F7 V( r' u* D(8)乏力。治疗乏力的影响因素,包括疼痛、焦虑、贫血和睡眠障碍等,维持适当水平的体育活动。
, Y: `, C. q6 ?* }1 p7 @ c7 ](9)焦虑。难以控制的过分焦虑和担心,睡眠障碍,坐立不安,肌肉紧张,易激惹,难以集中注意力或思维空白,易疲劳。
: o ^) z# W; c* H4 _& V心理干预:应向患者说明焦虑、抑郁在癌症生存者是很常见的问题,鼓励日常锻炼。9 V! X# l) W' z0 U
药物治疗:选择性5-羟色胺再摄取抑制剂,百忧解(氟西汀),赛乐特(盐酸帕罗西汀)。当药物完全起效并且患者症状部分或全部消失后,可逐渐减少剂量。
* w$ Y, b$ _& r" ?5 N4 A' @ R2 N0 U4.相关临床实验- U) `6 u2 k, S8 O. L9 i. l
(1)A Trial of Gefitinib in Combination With BKM120 in Patients With Advanced Non-Small Cell Lung Cancer, With Enrichment for Patients Whose Tumours Harbour Molecular Alterations of PI3K Pathway and Known to Overexpress EGFR0 Z7 Q# k7 `3 g- d" { T
http://www.clinicaltrials.gov/show/NCT01570296
0 q1 e; Z+ w! I& l6 k***************************************************************************
* z( S- \8 N% E3 Y* v4 Y9 j) S- z$ ]( i4 c; P& \$ @; V# O
背景:
& Y4 u, N" j0 s+ f# R克服吉非替尼耐药是现在重要的临床挑战, 现在所知道的耐药的原因包括EGFR T790M突变, MET扩增, 以及PI3K突变. 因为PI3K是中央的信号汇聚节点. 所以我们在这里假设联用 BKM120能克服EGFR耐药.) v0 Q# x" N9 X/ J6 }
方法:! ?6 c6 F5 S( ~
对吉非替尼耐药的病人参加了实验小组,来研究BKM-gef的安全性,耐受性,药代动力学性和药效。使用313用药模式,对于服用吉非替尼进展的病人逐步升级BKM的剂量(A组)。B组为服用吉非替尼而没有进展的病人,用药两周。为了测试对大脑的渗入能力,俩组各有一个脑转病人加入。病人在加入小组前都做了活检和PetCT。
5 v7 D) K! v5 t. w( ^4 d小组结果:
- P2 U7 @) _8 i& g, a( B; \15个病人服用了3个剂量的药, BKM 80 mg/d (6人), 100 mg/d (6人), 80 mg吃5天,停2天。同时每天服用250mg吉非替尼。A组(9人, 其中1名脑转病人), B组(6人, 其中1名脑转病人), 男女比例9:6,中位年纪63岁 (47-73岁),大部分为3线治疗。剂量限制毒性包括33.3%的病人在服用BKM120 100mg发生3级腹泻。常见的不良反应(所有剂量组)包括皮疹(80%),腹泻(73%),疲劳(60%),厌食(47%),黏膜炎(40%)。值得注意的是,40%的病人有延迟性3级毒性,例如皮疹,腹泻。
; ~3 U+ B9 |& J" ~! y3 n% p最大的服用计量为BKM120 80mg/d | 吉非替尼250mg/d, 为了提高服用安全性, 间歇服用BKM120 80mg(服药5天停药2天)也是可行的.
4 O' E G1 l2 j& c1 pB组, 4名病人服药2周后, PET-CT显示,3名病人SUVmax值降低,包括一位脑转病人。12个病人的活检结果显示50%的病人有T790M突变,40%的病人有MET扩增,没有病人有PI3K突变。A组,4名(44.4%)病人(2个T790M突变,1个MET扩增)有临床反应,包括轻微的肿瘤缩小和胸腔积液的减少,但是因为不良反应,不得不减少用药剂量。A组和B组通过服用加量的BKM120,40%的病人发现SUVmax下降25%,中位无进展时间为2.8月,两位脑转的病人的中位无进展时间分别为2.8月和10.7月。药代动力学还在分析中。4 j0 R0 v( e& O& X3 `* e1 s
结论:
# I4 }% Z: r: a联合用药的最大耐受剂量是吉非替尼250mg + BKM120 80mg每天。联合BKM120对已经产生吉非替尼耐药的病人起了抗肿瘤作用。对于BKM120的后期和持续性的毒副作用,另外的用药方案应被研究。最大耐受剂量组的临床试验正在进行中。临床试验组号为NCT01570296
: Q2 {6 T# s P& K1 z/ b7 L; q(2)Phase I, Dose-Escalation Study of BKM120, an Oral Pan-Class I PI3K Inhibitor, in Patients With Advanced Solid Tumors0 q% J) }# f; d+ E* {
http://jco.ascopubs.org/content/30/3/282.full- Z# H$ H2 m3 r) e0 h" T5 \
5 Z3 Y$ F! m( @. _" E一共有35名病人入组(肠癌15人,乳腺癌9人,肺癌2人,其它癌症9人),5人PI3K突变,10人Kras突变,11人PTEN缺失。一名Kras突变的乳腺癌病人肿瘤缩小超过50%(100mg/d);17名病人稳定,时间超过6周;有7人留在组内超过8个月(包括1名肺腺癌),其中5人有PI3K突变或者PTEN缺失。7 @* ~- X/ m( S5 A
(3)NCT01297491 Safety and Efficacy of BKM120 in Patients With Metastatic Non-small Cell Lung Cancer7 e5 r" N. M- K) m! H
http://clinicaltrials.gov/show/NCT01297491
& B, X& M0 X" ?% t( f5 f- @+ F: e3 X& E4 @' P
(4)NCT01487265 Trial of Erlotinib and BKM120 in Patients With Advanced Non Small Cell Lung Cancer Previously Sensitive to Erlotinib
8 V2 ]0 a7 P0 r9 D: Yhttp://clinicaltrials.gov/show/NCT01487265% {; x( U8 W+ j5 n
0 w+ H" e; m* E/ \
5.病人身体要求! K }" n, k, h$ ^0 `- M
(1)空腹血糖(FPG)≤120 mg/dL (6.7 mmol/L)。0 l4 Z) y6 q0 }+ c
(2)中性粒细胞绝对计数≥1500/μL。
: x; K: p" a4 D(3)血小板≥100,000/μL。
+ e/ G% U1 G8 e. e" a) s) |(4)血红蛋白≥9克/升。
" ^2 c8 ^* S. \8 f" b" i# t. O(5)肝转病人:谷丙转氨酶(ALT)和谷草转氨酶(AST) ≤3*正常水平上限(ULN),总胆红素≤1.5*正常水平上限(ULN)。
3 u. D# T( E( `1 o9 z/ C(6)电解质水平(钾、镁等)正常。% f; _6 B7 p: H
(7)肌酐≤1.5*正常水平上限(ULN)。
9 M5 K: `2 Z5 g$ q+ W(8)能够正常吞咽药物。: B% P: }# ]; b- K* L) C
6.适应对象" u. C0 P7 {( G/ ?% Y# Q
(1)肺腺癌病人中PI3K的突变率是2%,扩增率是6-19%,PTEN突变率是1%,缺失率是77%;肺鳞癌病人中PI3K的突变率是2-7%,扩增率是33-70%,PTEN突变率是6%,缺失率是70%。* h" ], I" o6 T4 E4 q) h
一项92例非小肺癌(男性63人,女性29人,腺癌64人,鳞癌28人,抽烟59人,从不抽烟33人)的肿瘤组织基因检测结果显示,PI3K扩增的病人为男性(11人),女性(0人);抽烟(11人),从不抽烟(0人);鳞癌10人,腺癌1人。8 J9 X2 g- f7 v
Coexistence of PIK3CA and other oncogene mutations in lung adenocarcinoma-rationale for comprehensive mutation profiling.
9 ]; z3 U8 \2 A6 i7 @9 z b, Qhttp://www.ncbi.nlm.nih.gov/pubmed/22135231" S8 i* K2 R# H6 ~& y
; ~% v" X& s/ e8 u一项1125例肺腺癌的肿瘤组织基因检测结果显示,PI3K突变的病人共有23人,占2%;其中女性13人,从不抽烟的8人,曾经抽烟的10人,一直抽烟的5人。另外有2人服用特罗凯耐药后获得PI3K突变。PI3K突变可与KRAS,MEK1,BRAF,ALK和EGFR突变共存。. G8 Y$ z8 |4 }4 D$ Z
(pik3ca) Mutation In Lung Squamous Cell Carcinoma3 `7 f+ t2 ~' S
http://www.atsjournals.org/doi/a ... tingAbstracts.A5614
5 N; W% A+ E7 D U5 T一项113例肺鳞癌的肿瘤组织基因检测结果显示,PI3K突变的病人共有6人,占5.3%, x$ ^3 O7 P2 ^; x9 ?# s* \
该6人无EGFR突变。脑转病人7人,其中有2人PI3K突变,提示PI3K突变与脑转可能有关联。
. c! n' p7 w" \% X0 [ yPIK3CA mutation status in Japanese lung cancer patients
/ _" I% M# z& X0 ^* G1 t" l; bhttp://www.deepdyve.com/lp/elsev ... patients-03K4NlOizB
9 b& j8 Y w' n" O1 o" K- V# s& B1 z0 L t7 P. K+ k0 D5 a
(2)临床前数据显示,Kras突变会导致对PI3K抑制剂耐药,但1期临床结果显示,一名Kras突变的乳腺癌病人有效缓解,一名Kras突变的肠癌病人稳定时间为3.5个月。
* H% {6 V5 f8 m0 e, b(3)肝细胞生长因子(HGF)是MET蛋白的配体,其在多种间质细胞及肿瘤细胞中均有表达,研究显示过表达的HGF可能通过GAB1信号途径诱导EGFR突变阳性的腺癌细胞对TKI产生继发性耐药。临床发现HGF在吸烟的肺癌患者中高表达,尼古丁可诱导NSCLC细胞株中HGF的过度表达,这亦可能与吸烟者接受EGFR-TKI治疗不敏感有关。
; b. Z$ Y' H# R* l; GEGFR TKI联合BKM120可以克服HGF过表达导致的EGFR耐药问题。( N6 U3 }" l8 p6 L$ }3 [
Transient PI3K inhibition induces apoptosis and overcomes HGF-mediated resistance to EGFR-TKIs in EGFR mutant lung cancer.
. p1 {. O# X$ x; Z. I% }http://www.ncbi.nlm.nih.gov/pubmed/212204743 d- ~$ [2 M+ _, y1 c. ]& D; E8 {. o
http://pharmastrategyblog.com/20 ... t-lung-cancer.html/
3 H0 z/ f! k3 C0 X) p" N- X(4)HER2突变或者扩增的肺癌或者乳腺癌病人,其应用BIBW2992或者PF00299804等Her2 TKI耐药后,可以联合BKM120。* p4 U) n5 u1 ^& v* Z) m
(5)对于T790M或者cMet扩增导致的EGFR耐药病人,PI3K/Akt信号通路上调,EGFR TKI联合BKM120有一定效果。 |